La réaction chimique et son équation
Le professeur simule une réaction chimique en mélangeant dans un cristallisoir des molécules de dihydrogène (H2 ) et des molécules de dioxygène (O2). La réaction produit de l’eau (H2O).
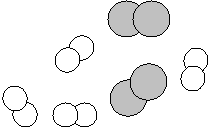
a°) Schématisez les corps présents dans le cristallisoir après la réaction chimique :
Avant la réaction (état initial) Après la réaction (état final)

![]()
![]()
dihydrogène dioxygène
b°) Donnez l’équation-chimique de cette réaction :
…………..…………………………………………………………………………………………………………….................
c°) Traduire par une phrase l’équation précédente en terme de molécules puis de moles :
……………………………………………………………………………………………………………………………………….
……………………………………………………………………………………………………………………………………….
d°) Remplir le tableau ci-dessous qui résume la situation a°) :
|
Quantité de dioxygène présente (mol) |
Quantité de dihydrogène présente (mol) |
Quantité d’eau présente (mol) | |
| Etat initial (avant que la réaction ne se produise) | .......................... | .......................... | .......................... |
| Etat final (quand la réaction est terminée) | .......................... | .......................... | .......................... |
![]()
e°) Faire le bilan molaire AVANT et APRES la réaction chimique pour qu’il ne reste plus de réactifs en fin de réaction :
| O2 | 2 H2O | ||
| Etat initial (avant que la réaction ne se produise) |
10 mol |
.......................... | .......................... |
| Etat final (quand la réaction est terminée) | .......................... | .......................... | .......................... |
Conclusion : Une équation chimique avec ses coefficients traduit ………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………….............................................