Le groupe anhydride d'acide s'écrit:
![]()
Contrôle de l'évolution d'un système chimique
(chapitre 14 de chimie)
Introduction :
La réaction d'estérification étudiée au chapitre précédent est limitée par ………………….. (réaction inverse de l’estérification).
L'idée est de remplacer l'acide carboxylique de départ par un anhydride d'acide de façon à rendre la réaction ...........................
L'idée est de remplacer l'eau obtenue dans les produits par une autre espèce qui ne réagirait pas avec l’ester. On aurait donc
une réaction ……………… avec un rendement de …………. par rapport au réactif limitant.
1°) Groupe anhydride d'acide :
|
|
|
|
Le groupe anhydride d'acide s'écrit: |
|
2°) Formule générale d'un anhydride d'acide :
|
|
|
|
La formule générale d'un anhydride d'acide est: |
|
Dans cette formule R représente soit une chaîne ……………….. soit un atome ………………………………..
3°) Obtention d'un anhydride d'acide :
On obtient un anhydride d'acide en éliminant une molécule d'eau entre deux molécules d'acide carboxylique. C'est une
transformation que l'on peut schématiser par l'équation suivante:
![]()
4°) Nomenclature des anhydrides d'acides :
Pour nommer un anhydride d'acide, on fait précéder le nom de l'acide dont il dérive du mot anhydride. Par exemple:
|
|
dérive de l'acide éthanoïque et est appelé anhydride …………………..(ou anhydride acétique). |
5°) Propriétés des anhydrides d'acides :
Les anhydrides d'acides sont plus réactifs que les acides dont ils dérivent. En particulier, ils réagissent rapidement avec
l'eau (hydrolyse) pour redonner l' acide correspondant suivant l'équation:
![]()
II°) Estérification réalisée à partir d'un anhydride d'acide :
1°) Equation de la réaction :
………………….+ …………………... ® ………………..+ …………………….
La réaction est: -rapide (quelques minutes ) alors qu’il fallait plusieurs jours avec un …………………………….
- totale (l'eau ne fait pas partie des ………………….. de la réaction. Il n'y a donc pas d'hydrolyse de l'ester
pour la limiter). Le rendement est quasi de ………. expérimentalement.
2°) Application à la synthèse de l'aspirine (voir TP n°23 de chimie ):
On réalise l'estérification du groupe C—OH de la molécule d'acide salicylique par l'anhydride éthanoïque. L'équation est la
suivante:
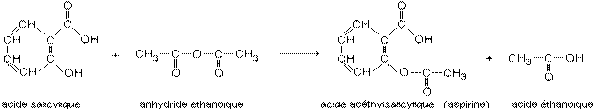
Pour que la synthèse soit plus rapide (environ 10 minutes) on la réalise à environ 60°C avec un catalyseur (l’acide sulfurique).
III°) Hydrolyse basique d'un ester ou réaction de saponification :
1°) Equation de la réaction :
|
|
|
|
L'équation de la réaction s'écrit: |
|
………………… .+ ion hydroxyde ® ion ………………..+ ………..
en remplaçant l'eau par l'ion hydroxyde, on place le milieu réactionnel en milieu …………... C'est alors l'ion
……………… et non l'acide qui est formé. L'hydrolyse ne peut plus ………………………………... Cette réaction
est lente à température ordinaire mais elle est totale. Pour accélérer celle-ci on travaille à chaud (90°C°). Le savon est constitué
par l’association de l’ion carboxylate et de l’ion sodium provenant de la soude (Na+ + OH-)° : …………………………………
2°) Application à la préparation d'un savon :
1°) Acide gras :
On appelle acide gras les acides carboxyliques à longues chaînes carbonées. Cette chaîne carbonée comporte, en
général, de 10 à 20 atomes de carbone mais l'acide butyrique (ou ……………….) qui présente une chaîne carbonée à
4 atomes de carbone est considéré malgré tout comme un acide gras.
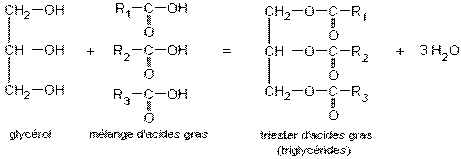
2°) Triester d'acide gras :
Le glycérol ou propan-1,2,3-triol est une molécule qui présente deux groupes alcool primaire et un groupe alcool secondaire.
Sa formule est donnée ci-contre.
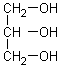
Lorsque les trois fonctions alcool du glycérol sont estérifiées par un ou plusieurs acides gras différents, on obtient un
triester d'acide gras ou triglycéride. Ces triglycérides sont les constituants essentiels des corps gras (huiles et graisses
végétales et animales).
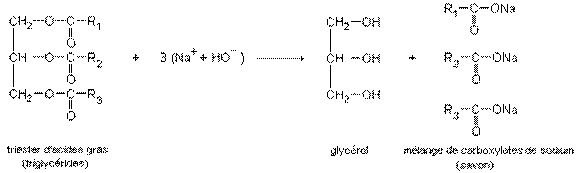
3°) Saponification d'un triester d'acides gras :
La saponification d'un triester d'acides gras est l'hydrolyse basique des trois fonctions ester du triglycéride. Elle conduit au
……………………….. et à un mélange de carboxylates de sodium (ou de potassium). Ce mélange de carboxylates de sodium
(ou de potassium) est appelé savon.
En fait, lors de cette préparation, on obtient une solution de carboxylates de sodium de formule générale: R—COO- +Na+.
En plongeant cette préparation dans de l'eau salée contenant du chlorure de sodium, on déplace l'équilibre
R—COONa = R—COO- +Na+ dans le sens de la formation du carboxylate de sodium (savon) R—COONa. Cette opération
est appelée relargage,on obtient le précipité (solide).
Un savon est donc soluble dans l'eau pure ,l’équilibre R—COONa = R—COO- +Na+ ) est favorisée de la gauche vers la
droite). Par contre le savon est très peu soluble dans l'eau salée (comme dans l'eau dure, c'est-à-dire riche en ions calcium
Ca2+), l’équilibre ci-dessus est favorisée de la …………………………………. Conclusion : un savon n’a aucun pouvoir
dans une eau dure ou salée.
4°) Propriétés détergentes d'un savon :
Les propriétés détergentes d'un savon sont dues essentiellement aux ions carboxylates.
1°) Propriétés de l'ion carboxylate :
Un ion carboxylate d'un savon est formé d'une longue chaîne carbonée R quasi non polaire que nous appellerons
queue de l'ion, et d'un groupe d'atomes —COO- polarisé que nous appellerons tête de l'ion carboxylate. On le
représente comme il est indiqué ci-contre.
![]()
La tête polarisée (—COO-) possède une affinité marquée pour l'eau qui est un solvant…………. Cette partie de l'ion
carboxylate est hydrophile. Au contraire cette tête n'a pas d'affinité pour les chaînes carbonées non polaires donc pour
les corps gras présents dans les lipides. La tête est ……………...
De la même façon la queue est lipophile (affinité pour les chaînes carbonées dont la structure est semblable), et ……………….(…………………………..).
2°) Modes d'action d'un savon :
Ils sont résumés sur les schémas ci-dessous.
|
|
Lorsque la concentration en savon (ions carboxylate) est relativement faible, le savon se dispose en monocouche à la surface de l'eau, créant ainsi un film à l'interface eau-air. La tête hydrophile étant dans l'eau et la queue hydrophobe dans l'air. |
|
|
|
|
|
Une bulle de savon présente deux interfaces air-eau. Les ions carboxylate sont disposés comme le montre le schéma. A l'intérieur, il y a de l'air, car les queues hydrophobes empêchent l'eau de s'y trouver. |
|
|
|
|
|
Lorsque la concentration du savon devient plus importante, les ions carboxylate se regroupent en agrégats appelés micelles, de telle façon que les têtes se tournent du côté de l'eau et queues serrées les unes contre les autres s'en protègent. |
|
|
|
|
|
Pour enlever une tache de graisse, les ions carboxylate se fixent à celle-ci par leur queue lipophile et leur tête hydrophile est liée à l'eau. L'ensemble ainsi formé est évacué lors du rinçage. |