Transformations forcées : l'électrolyse (chapitre 12 de chimie)
Introduction : Au sein des végétaux, s’effectuent naturellement des transformations forcées qui permettent aux plantes de se
développer selon un processus appelé photosynthèse. L’homme sait également réaliser des transformations,
l’électrolyse, par exemple, dont les applications sont nombreuses.
I°) Des transformations spontanées aux transformations forcées :
a°) Réaction spontanée entre le cuivre (métal) et le dibrome en solution aqueuse :
Expérience : Dans un tube à essais, on met en présence de la tournure de cuivre (Cu) et du dibrome (Br2) en solution
aqueuse ([Br2]i=1,0.10-2 mol.L-1). La solution initialement jaune (couleur du dibrome en solution aqueuse) se colore
progressivement en …………………….(couleur d'une solution aqueuse d'ions………………….) et le cuivre métallique est
…………………………………………………...
|
L'équation de cette réaction est: |
……… + ……… = ………… + …………… |
avec: K = 1,2.1025 |
Cette évolution est spontanée dans le sens direct de l'équation, ce qui est en accord avec le critère d'évolution :
Qri =![]() ® Qri=
® Qri=
![]() ………………………….
………………………….
K >> 104 la réaction est quasi totale dans le sens direct de l'équation. Le taux d'avancement final est très proche de 1 (100%).
b°)Transformation forcée :
1°) Expérience :
On réalise l'expérience schématisée ci-dessous.
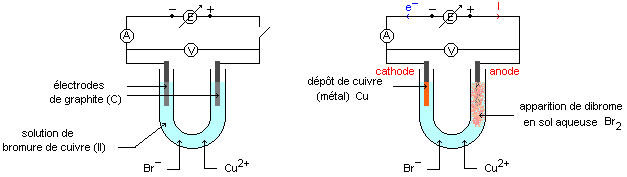
Le symbole du générateur barré d'une flèche représente un générateur dont on peut faire varier progressivement la
tension entre ses bornes. Nous appliquons une tension d’environ 2V, on observe un dépôt de ……………….sur
l'électrode négative et l'apparition de ……………………..de couleur …………………….en solution au voisinage de
l'électrode positive.
2°) Interprétations :
|
|
|
|
|
A la cathode: |
……….. + 2e- = ….......... |
gain d'électrons, c'est une …………………… |
|
|
|
|
|
A l'anode: |
……….= ……… + 2e- |
perte d'électrons c'est une ………………………… |
|
|
|
|
|
Bilan |
……………. = ………………. |
|
Ce bilan est …………………………… de celui correspondant à l'évolution spontanée.
3°) Généralisation :
|
Lorsqu'un générateur de tension continue impose dans un système chimique un courant de sens inverse à celui qui est observé lorsque le système évolue spontanément (……….), il peut imposer à ce système d'évoluer dans le sens …………………de son sens d'évolution spontanée. Cette transformation forcée est appelée……………………….. L'électrode à laquelle se produit une oxydation est appelée …………………..(électrode par laquelle le ………………entre dans l'électrolyseur). L'électrode à laquelle se produit une réduction est appelée ………………..(électrode par laquelle le courant sort de l'électrolyseur).
|

II II °) Applications de l'électrolyse :
1°) Quelques applications de l'électrolyse.
Voici quelques domaines d'utilisations de l'électrolyse.
Préparation ou purification de certains métaux: le zinc et l'aluminium sont préparés par électrolyse d'une solution contenant
leurs cations ou leurs oxydes.
Préparation de substances non métalliques: Le dichlore et la soude sont préparés par électrolyse d'une saumure (solution
très concentrée de chlorure de sodium).
Dépôts de métaux sur un support: Ils se font par électrolyse à anode soluble. L'électrolyte contient les cations du métal à
déposer. La cathode est constituée de l'objet (métallisé) à recouvrir. La galvanoplastie (voir livre p 232) a pour but de
reproduire un objet, la galvanostégie a pour but de le protéger.
Les accumulateurs ou les piles rechargeables font intervenir l'électrolyse lors de la phase de recharge.
2°) Les accumulateurs :
a°) Définition.
|
Un accumulateur est un système chimique. Il peut: Ø Fournir de ………………………………à un circuit extérieur lorsqu'il évolue de façon spontanée. Il fonctionne alors en générateur et fait passer dans ce circuit extérieur un courant dont le sens est imposé par la transformation chimique spontanée. L'accumulateur se décharge. Ø Fonctionner en ………………………..lorsqu'on le branche aux bornes d'un générateur qui impose un sens de courant inverse du précédent. Le système évolue alors dans le sens contraire de son sens d'évolution spontanée. l'accumulateur se charge.
|

b°) Exemple: l'accumulateur au plomb (batterie d'automobile).
1°) Schéma de principe.
Le schéma ci-dessous représente un accumulateur au plomb pendant la phase de décharge.
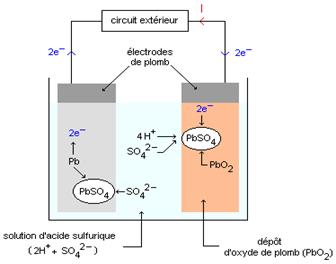
2°) Equations aux électrodes et bilan électrochimique pendant la décharge :
|
|
|
|
A la borne positive: |
PbO2 + 4H+ + 2e- = Pb 2+ + 2H2O (couple PbO2/Pb2+) |
|
|
|
|
A la borne négative: |
Pb = Pb 2+ + 2e-(couple Pb2+/Pb) |
|
|
|
|
Bilan électrochimique: |
………………………………….=………………………………………. |
Pendant la charge, la réaction se déroule dans le sens ………. et les réactifs sont …………...
La f.é.m est de l'ordre de 2V.
c°) Réactions spontanées et réactions forcées dans le monde vivant.
Il existe en chimie et en biochimie des réactions spontanées et des réactions forcées. Par exemple: la respiration et la
photosynthèse chlorophyllienne.
La respiration.
C'est un processus biologique dont le déroulement complexe passe par la dégradation d'un nutriment organique. Il apparaît
une succession de réactions d'oxydoréduction mettant en jeu le dioxygène. Elle a, entre autres, pour effet de synthétiser la
molécule d'ATP, réservoir d'énergie des cellules. Par exemple:
dégradation du glucose ………………………….+ 6O2 = ………………….
C'est une réaction spontanée dans le sens direct.
La synthèse chlorophyllienne.
Il s'agit de la synthèse de matière organique avec l'aide de la lumière par les végétaux dits"chlorophylliens".
6CO2 + 6H2O = C6H12O6 + 6O2
Il s'agit de la réaction ……………………..de la précédente (respiration). C’est donc nécessairement une réaction ……....
L’énergie nécessaire est apportée par la lumière.