Estérification et hydrolyse
(Chapitre 13 de chimie)
Introduction :
Il faut aborder ce chapitre et le suivant en ayant pour objectif de comprendre que l'on peut contrôler les transformations
chimiques. C'est-à-dire qu'il est possible d'agir sur une transformation de façon à modifier sa ………………..ou la composition
du système à l'équilibre. Nous prendrons comme exemple de réaction, la fabrication des esters (molécules qui entrent dans la
composition d’un grand nombre d’arômes
naturels).
I°) Les esters :
1°) Groupe
caractéristique : le groupe
caractéristique d’un ester est :
![]()
2°) Formule générale d'un
ester : ![]() R est un atome d'hydrogène ou une chaîne carbonée.
R est un atome d'hydrogène ou une chaîne carbonée.
R' est une chaîne carbonée.
3°) Nomenclature :
Un ester est le produit de la réaction entre un acide carboxylique et un alcool (voir rappel sur les différents alcools).
On retrouve donc dans la formule d'un ester un groupe d'atomes venant de ……………………………...
(groupe carboxylate: R—COO—) et un groupe alkyle R'— venant de ………………… R'—OH. Un ester se présente donc
comme un carboxylate d'alkyle. La nomenclature des esters est déduite de cette analyse.
Exemple:
|
Ester |
Acide |
Alcool |
Nom de l'ester |
|
|
|
|
éthanoate de méthyle |
de la même façon, C6H5—COO—C2H5 est le benzoate d'éthyle
![]()
4°) Rappel sur les alcools : -un alcool primaire est un alcool de formule (un seul alkyle -R sur l’atome de
carbone portant –OH) exemples ………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………......
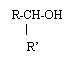
- un alcool secondaire est un alcool de formule deux groupes alkyle –R et –R’ sur l’atome de carbone
portant –OH) exemples :……………………………………………………………………………………………………………
...............................................................................................................................................................................................................
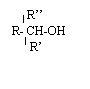
- un alcool tertiaire est un alcool de formule trois groupes alkyle ………………sur l’atome de carbone portant
–OH) exemples :………………………………………………………………………………………………………………..........................
………………………………………………………………………………………………………………………….....................................
II°) Estérification et hydrolyse de l'ester :
1°) Equation de la réaction :
L'estérification est la réaction qui permet d'obtenir un ester. On peut, pour cela faire réagir un acide carboxylique R—COOH avec
un alcool R'—OH. Cette réaction conduit à un ester R—COO—R' et de l'eau suivant l'équation:
………………………………………………………………………………………………………………………………................................
La réaction en sens inverse entre l'ester et l'eau qui conduit à un alcool et à un acide carboxylique est appelée …………..……de
l'ester et se produit simultanément.
2°) Propriétés des réactions d'estérification et d'hydrolyse de l'ester (TP n°21) :
Ces deux réactions sont : ………………., ……………………par leur réaction inverse (l'estérification est limitée par l'hydrolyse de
l'ester formé).
3°) Méthode expérimentale permettant de suivre l'évolution de la transformation :
Pour suivre l'évolution de ces transformations on dose à des dates t l'acide présent dans le milieu réactionnel (comme dans le TP
N°21 pour les mélanges 3 et 4). La connaissance des quantités de matière d'acide initiale et à l'instant t permet de déterminer le
taux d'avancement de la réaction.
Pour l'estérification, considérons l'exemple d'un mélange équimolaire d'acide éthanoïque et d'éthanol (alcool primaire). Le tableau
d'avancement est :
|
Équation de la réaction |
CH3-COOH + CH3-CH2OH = ……………………...+………….. |
|||
|
E.I (mol) |
n0 |
n0 |
n(est)0=0 |
n(H2O)0=0 |
|
E.Inter (mol) |
n(ac)=……. |
n(al)=……… |
n(est)=…….… |
n(H2O)=…….. |
|
E.final (mol) |
n(ac)f=…….. |
n(al)= …….... |
n(est)f=………. |
n(H2O)f= ……. |
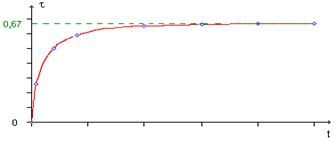
On a donc x=…………... La quantité de matière d'acide à la date t est déterminée par dosage d'un échantillon du milieu
réactionnel.
xmax=n0. Le taux
d’avancement de la réaction est t=……………………=……………………………..
L'allure de la courbe t=f(t) est donné ci-dessous.
4°) Etat d'équilibre :
a°) Point de vue cinétique :
L'état d'équilibre est la situation pour laquelle la vitesse de la réaction d'estérification est la même que la vitesse d'hydrolyse de l'ester formé. Les deux réactions se ……………………. Globalement la composition du mélange ne varie plus (il y a autant d’ester formé lors de l’estérification que d’ester consommé lors …………..……….Les quatre espèces (acide, alcool, ester et eau) coexistent.
b°) Quotient de réaction et constante d'équilibre :
Le quotient de réaction s’écrit : Qr=
![]()
La constante d’équilibre s’écrit : K=![]() =
=![]()
On remarquera que, dans ce cas particulier, l'eau figure dans les expressions de Qr et de K. Cela tient au fait que l'eau n'est pas considérée ici comme le solvant mais comme un simple produit de l'estérification ou un simple réactif de l'hydrolyse de l'ester.
III°) Influence de certains facteurs sur les réactions d'estérification et d'hydrolyse des esters
1°) Introduction :
Ces facteurs peuvent modifier la vitesse de réaction ou la composition du milieu réactionnel à l'équilibre.
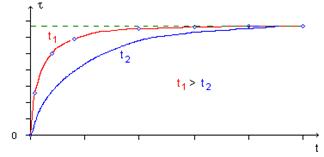
2°) Influence de la température :
- Une modification de la température du milieu réactionnel est sans influence sur le taux d'avancement final. Cela est du au
fait que ces réactions sont athermiques. Cela signifie aussi que la ……………………………….est indépendante de la
température, contrairement à ce qui est observé pour la grande majorité des autres transformations.
- Cependant qu'il s'agisse de l'estérification ou de l'hydrolyse d'un ester, une élévation de la température du milieu réactionnel
augmente la vitesse de réaction. Cela signifie que l'équilibre est …………………………………………….
(sans que la composition à l'équilibre soit modifiée).
3°) Influence d'un catalyseur (TP N°21) :
a°) Définition d'un catalyseur :
Un catalyseur est une espèce chimique, introduite dans le milieu réactionnel, qui a pour effet ……………….…….. la vitesse de
réaction sans figurer dans l'équation de la réaction
b°) Catalyse des réactions d'estérification et d'hydrolyse de l'ester :
Les ions oxonium (H3O+ provenant de l’acide sulfurique) catalysent aussi bien la réaction d'estérification que la réaction
inverse. Ce catalyseur permet d'atteindre ……………………………..l'état d'équilibre sans changer la composition du
milieu réactionnel à……………………………
4°) Influence de la composition initiale (TP N°21)
a°) Sur le taux d'avancement final (composition à l'équilibre) :
Le taux d'avancement final (donc la composition du système à l'équilibre) dépend de la composition initiale du système. Le
![]() tableau
de valeurs donné ci-contre, concernant un mélange d'acide éthanoïque et
d'éthanol (alcool primaire) permet de
tableau
de valeurs donné ci-contre, concernant un mélange d'acide éthanoïque et
d'éthanol (alcool primaire) permet de
comprendre cette influence (en Tp nous avons montré cette influence avec les mélanges ……………..).
On observe que, par rapport au réactif limitant, plus la quantité de matière de l'autre réactif (…………) est importante plus le taux d'avancement final est…………., donc plus il y a d'ester formé. La même remarque est valable (avec des valeurs numériques différentes) pour la réaction d'hydrolyse de l'ester.
b°) Rendement de l'estérification :
Le rendement de l'estérification est le rapport entre la quantité de matière d'ester effectivement obtenue nef et la quantité de
matière d'ester que l'on obtiendrait si la réaction était………….. nt
: h
(rendement)=
![]()
or si la réaction était totale on aurait: nt= …………où …………est égal à la quantité de matière initiale de réactif limitant.
D’autre part nef = xf = xéq, quand le système chimique atteint l'équilibre, seulement dans ce cas le rendement s’écrit :
h
(rendement)=![]() =
=![]() . (………………………….……….)
. (………………………….……….)
Si la réaction est arrêtée avant d'atteindre l'équilibre, nef < xeq alors h < t
Pour améliorer le rendement par rapport au réactif limitant d'une estérification on utilisera un large……….….. de l'autre réactif.
Pour améliorer le rendement de l'hydrolyse d'un ester on utilisera un large excès d'eau.
5°) Influence de la nature des réactifs :
Le taux d'avancement de l'estérification ne dépend pratiquement pas de la nature de l'acide carboxylique utilisé. Par contre la
classe de l'alcool est déterminante comme le montre les valeurs indicatives concernant un mélange équimolaire d'acide et
d'alcool données dans le tableau
ci-dessous:
|
t = 67% |
pour un alcool primaire R'—CH2—OH |
|
t = 60% |
pour un alcool secondaire R'—CHOH—R" |
|
t = 5% |
pour un alcool
tertiaire |
IV°) Contrôle des réactions d'estérification et d'hydrolyse :
1°) Contrôle de la vitesse de réaction :
L'augmentation de la température et l'emploi d'un catalyseur (H+) permettent d'atteindre plus ………………..l'état d'équilibre
sans modifier sa composition.
On pourra aussi ralentir ces réactions en abaissant la température (…………….du milieu pour effectuer un dosage de l'acide présent).
2°) Contrôle de la composition du système dans l'état final :
Le but est en général d'augmenter le rendement
de la réaction. L'équation de la réaction est:
R—COOH + R'—OH = R—COO—R' + H2O
avec K=![]()
a°) Déplacement de l'équilibre en utilisant un excès de l'un des réactifs :
Considérons l'état d'équilibre du système comme état initial. Si, dans cet état, on ajoute un excès de l'un des réactifs (par
exemple de l'acide), n(ac)ini > n(ac)éq et de ce fait ……… < ……………
Le système va évoluer de façon que ……..tende vers ………. Pour cela il va évoluer dans le sens ……….de l'équation,
c'est-à-dire dans le sens de l'élimination de l'espèce ajoutée ou dans le sens de la production de l'ester. Le raisonnement
est identique si l'on ajoute de l'alcool. Donc :
- Si l'on veut augmenter le rendement lors de la production d'ester, il suffit d'augmenter la quantité de matière de l'un des
……………..(le moins cher).
- Si l'on veut augmenter le rendement lors de la production d'un alcool (ou d'un acide), il suffit d'utiliser un large excès
………………………..
b°) Déplacement de l'équilibre en éliminant l'un des produits de la réaction :
Considérons l'état d'équilibre du système comme état initial. Si, dans cet état on élimine l'un des produits (par exemple de
l'eau), n(eau)ini < n(eau)éq et de ce fait……………………….
Le système va évoluer de façon que Qr tende vers K. Pour cela il va évoluer dans le sens ………..de l'équation, c'est-à-dire
dans le sens de la production de l'espèce éliminée ou dans le sens de la production……………………….. Le raisonnement
est identique si l'on élimine l'ester. Donc:
Si l'on veut augmenter le rendement lors de la production d'ester, il suffit d'éliminer l'un des produits de la réaction.
Conclusion : - Lors de la préparation d'un ester on utilisera donc un chauffage à reflux (voir p 271) pour augmenter la………..
de la réaction et parvenir plus rapidement à l'équilibre sans perdre de réactifs ( ils se vaporisent, ils se condensent dans
le réfrigérant et retombent dans le milieu réactionnel) et un catalyseur (on ne modifie pas la ………………..)
- Pour améliorer le rendement, on pourra éliminer ……… ou l'ester …………… par distillation fractionnée si les températures d'ébullition le permettent (voir p271)