Evolution spontanée d'un système chimique vers un état d'équilibre
(chapitre 10 de chimie)
Introduction : La patine noble des bronzes antiques est due à des transformations très lentes s’effectuant spontanément dans
un sens déterminé, celui de l’oxydation du cuivre constituant ces alliages.
Comment déterminer le sens d’évolution spontanée d’un système chimique ?
I°) Critère d’évolution spontanée vers un état d'équilibre :
1°) Rappels :
A la réaction d'équation: aA + bB ® cC + dD est associé le quotient de réaction: Qr=………………….
dans l'état initial: Qri
= ![]() . A l'équilibre, Qréq = K tel que:
K=………………………………………
. A l'équilibre, Qréq = K tel que:
K=………………………………………
Seules les espèces présentes en solution doivent figurer dans l'expression de K. Les solides, les gaz non dissous et l'eau
n'y figurent pas.
2°) Critère d'évolution :
![Zone de Texte: Trois cas peuvent se présenter :
Qri = K: Le système chimique est à l'équilibre. Il n'évolue plus.
Qri < K: Cela signifie que le numérateur de Qri est trop ……….. par rapport à son ………………. Le système va
évoluer de façon à ce que le numérateur [C]c[D]d ……………….et que le dénominateur [A]a[B]b ……………jusqu'à
ce que ce rapport devienne égal à K. Pour cela le système va évoluer dans le sens de formation de …………………,
c'est-à-dire de la gauche vers la droite (sens direct de l'équation de la réaction).
Qri > K : C'est l'inverse qui se produit. [C]c[D]d est trop ……………par rapport à [A]a[B]b. Le système va évoluer
dans le sens de formation de A et B. C'est-à-dire de la …………….vers ………………..(sens inverse du sens
direct de l'équation de la réaction).](evolutionspontanee_fichiers/image003.gif)
3°) Critère d'évolution sous forme d'un diagramme :
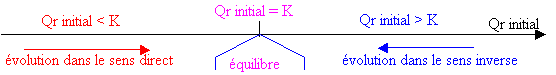
Conclusion :
II°) Exemples :
1°) Réaction acido-basique :
Il faut une transformation suffisamment rapide pour que l’état d’équilibre du système soit atteint quasi instantanément,
d’où le choix des réactions acido-basiques.
La manipulation proposée met en jeu des solutions dans lesquelles interviennent deux couples acide/base pour lesquels les pKA sont donnés :
Couple
1 ‘acide éthanoïque/ion éthanoate: ![]() pKA1 = 4,8 KA1
= 1,8.10-5
pKA1 = 4,8 KA1
= 1,8.10-5
Couple 2 :
acide méthanoïque/ion méthanoate :![]() pKA2 = 3,8 KA2
= 1,8.10-4
pKA2 = 3,8 KA2
= 1,8.10-4
Ecrire l’équation de la réaction acido-basique susceptible de se produire entre ces deux couples :
…………………………………………………………………………………………………………………………………
Cette écriture ne préjuge pas du sens dans lequel a lieu la transformation.
Cette réaction est caractérisée par une constante d’équilibre K = ……………….…=…………………….
2 mélanges seront réalisés de la façon suivante :
|
Mélange |
1 |
2 |
|
V1 (acide éthanoïque) |
10 |
20 |
|
V2 (éthanoate de sodium) |
10 |
1 |
|
V3 (acide méthanoïque) |
10 |
5 |
|
V4 (méthanoate de sodium) |
10 |
10 |
Les volumes sont exprimés en mL et toutes les solutions utilisées ont la même concentration c = 1,0.10-1 mol.L-1
Première étape : calcul du quotient de réaction dans l’état initial du système après mélange fictif « avant » réaction
Etat initial du système
Le quotient
de réaction dans l’état initial du système s’écrit :Qr,i =
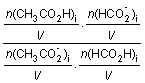
avec V = V1 + V2 + V3 + V4
Cette expression peut se simplifier par Qr,i= ………………………………………………….=…………………………………….
La valeur de Qr,i pour chacun des deux mélanges figure dans le tableau ci-dessous :
|
Mélange |
1 |
2 |
|
Qr,i (calculé) |
……….. |
……………… |
Deuxième étape : Sachant que, quel que soit l’état initial d’un système, Qr tend vers K, prévoir l’évolution du système.
Le vérifier par une mesure du pH du mélange considéré .
Mélange 1
a) Prévision du sens d’évolution du système
Qr,i est plus …….. que K (….. < ……) ; le quotient de réaction va donc croître au cours de la transformation, puisque Qr
tend vers K. On prévoit donc que le système évolue dans le sens …………….........(de ………….à………….).
Ainsi, les concentrations des espèces vont évoluer au cours de la transformation de manière à provoquer l’accroissement
du quotient de réaction Qr. Compte tenu de l’équation proposée, il y a lieu de prévoir :
- un accroissement des concentrations molaires : [……….] et […………]
- une diminution des concentrations molaires : […………] et […………],
ce qui
peut se dire aussi : - le rapport [![]() ] / [CH3CO2H] doit …………………….
] / [CH3CO2H] doit …………………….
- le
rapport [![]() ] / [HCOOH] doit ……………………………..
] / [HCOOH] doit ……………………………..
b) Vérification expérimentale du sens d’évolution par la mesure du pH
La mesure du pH du mélange 1 donne pH1 = ……………
|
Etat initial |
Etat d’équilibre |
|
|
|
Ainsi le
rapport [![]() ] / [CH3CO2H] a …………………..
] / [CH3CO2H] a …………………..
donc [CH3CO2H]
a ………………….et [![]() ] a ………………………
] a ………………………
Le système a évolué dans le sens direct conformément aux prévisions.
La
démonstration peut aussi se faire en prenant le couple HCO2H(aq) /
HCO![]() (aq).
(aq).
a) Prévision du sens d’évolution du système
Qr,i est plus ………..que K ( > ………….) ; le quotient de réaction va donc ……………..au cours de la transformation,
puisque Qr tend vers K. On prévoit donc que le système évolue dans le sens …………………..(de droite à gauche).
Les concentrations des espèces vont évoluer au cours de la transformation de manière à provoquer la diminution de Qr.
Compte tenu de l’équation proposée, il y a lieu de prévoir :
- une diminution des concentrations molaires : [………….] et […………….]
- une augmentation des concentrations molaires : […………………..] et […………………………]
ce qui peut se dire aussi :
- le rapport [![]() ] / [CH3CO2H] doit …………….
] / [CH3CO2H] doit …………….
-
le rapport [![]() ] / [HCOOH] doit…………………...
] / [HCOOH] doit…………………...
b) Vérification expérimentale du sens d’évolution par la mesure du pH
La mesure du pH du mélange 2 donne pH2 = .............
|
Etat initial |
Etat d’équilibre |
|
|
|
Ce rapport a donc bien……………………, le système a évolué dans le sens prévu.
2°) Réactions rédox :
On dispose d'une solution 1 de sulfate de cuivre (II) de concentration c1=0,10 mol.L-1, d'une solution 2 de sulfate de zinc
de concentration c2=0,20 mol.L-1,
de cuivre en poudre et de zinc en poudre.
Dans un bécher, on
place un volume v1= 20,0mL de la solution 1, v2= 20,0mL de
la solution 2 ainsi que 10 g de poudre de
cuivre et 20 g de poudre de zinc.
1. Déterminer le quotient de réaction initial associé à l'équation: Cu2+ + Zn = Zn2+ + Cu.
2. Déterminer le sens d'évolution spontanée de la réaction, sachant que la constante d'équilibre associée à cette équation
est K=1,9.107.
Solution.
|
1. Le quotient de réaction initial est: |
|
les quantités de matières apportées initialement sont:n(Zn2+)i =c2v2 et n(Cu2+)i=c1v1. Alors
|
=> |
|
||||
|
|
=> |
Qri = 2 |
2. On observe donc que Qri ............. K. Le système chimique va évoluer dans le sens .......de l'équation, c'est-à-dire de la ...................
vers la ............................ On va avoir apparition de cuivre métallique (confirmé expérimentalement).