![Zone de Texte: Le produit ionique de l'eau est la constante d'équilibre associée à l'équation d'autoprotolyse de l'eau. Cette constante est notée Ke. On a donc: Ke=[H3O+].[HO-] Ke s'exprime sans unité alors que les concentrations sont exprimées en …………………….](transfoacidobasiques_fichiers/image001.gif)
Transformations associés à des réactions acido-basiques
(chapitre 8 de chimie)
Introduction : Nous avons vu dans le chapitre précédent qu’une transformation chimique pouvait être caractérisée
par une constante d’équilibre. Nous allons utiliser cette notion pour faire ressortir d’autres relations avec des réactions
acido-basiques.
I°) Autoprotolyse de l’eau :
1°) pH de l'eau pure :
Le pH de l'eau pure à 25°C est …………….. Cette valeur est prise comme référence pour définir un milieu neutre
du point de vue acido-basique. Dans l'eau pure à 25°C on a donc [H3O+] = 10-pH= ………………………..mol.L-1
2°) Comment expliquer la présence d’ions H3O+ dans de l’eau pure ? (Autoprotolyse de l’eau) :
L'autoprotolyse de l'eau est la réaction entre deux molécules d’eau suivant le bilan :
H2O + H2O = H3O+ + OH-. Cette réaction a lieu car l’eau est ……………………………(Elle est à la fois acide et
basique).Cette réaction est très peu avancée ([H3O+] est très faible).
On remarquera avec l’équation bilan ci-dessus que: [H3O+]…………….
3°) Produit ionique de l'eau :
a°) Définition :
[HO-] Ke s'exprime sans unité alors que les concentrations sont exprimées en …………………….
![Zone de Texte: Le produit ionique de l'eau est la constante d'équilibre associée à l'équation d'autoprotolyse de l'eau. Cette constante est notée Ke. On a donc: Ke=[H3O+].[HO-] Ke s'exprime sans unité alors que les concentrations sont exprimées en …………………….](transfoacidobasiques_fichiers/image001.gif)
b°) Propriété et notation :
La constante d'équilibre est indépendante de l'état initial (en particulier de la concentration initiale) et ne dépend que de la
température. Donc, pour toute solution aqueuse à 25°C, on a: Ke=………………...=……………….=……..
On note: pKe = - log Ke donc pKe = ………………….=………. à 25°C. Cette constante dépend de la température .
|
Température |
Ke |
pKe |
|
0 |
0,11.10-14 |
15 |
|
25 |
1,0.10-14 |
14 |
|
100 |
55,2.10-14 |
12.3 |
c°) Échelle de pH :
Le pH des solutions aqueuses usuelles s'étend de 0 à 14. La nature acide, basique ou neutre d'une solution dépend de
son pH. Les différentes situations possibles sont résumées sur l'échelle de pH donnée ci-dessous.
|
pH à 25°C |
 milieu acide milieu neutre
milieu basique
milieu acide milieu neutre
milieu basique
0 [H3O+] >[OH-] 7 [H3O+]<[OH-] 14
[H3O+]=[OH-] (donc pH=……………..)
II°) Constante d’acidité :
1°) Définition :
La constante d’acidité ne dépend que de la température. C’est à dire, qu’elle
reste valable quelque soit le mélange d’acides , de bases ou autres présents
dans la solution.
En prenant le logarithme (en base 10) : log KA=……………………………………... donc
pH= ………………………..............
Exemple de couples voir livre (annexe à la fin). Noter que A- ou B correspond à l’espèce …………….........
(capable de………... un proton) , HA ou BH+ correspond à l’espèce
………………….......(capable de ……………..un proton)
![Zone de Texte: L’équation de la réaction associée à la transformation lorsqu’on met un acide dans l’eau est :
HA + H2O = H3O + + A-
La constante d’équilibre associée à cette réaction se nomme constante d’acidité du couple HA /A-
KA=[A-]eq.[H3O+]eq/[HA]eq
La constante d’acidité ne dépend que de la température. C’est à dire, qu’elle reste valable quelque soit le mélange d’acides , de bases ou autres présents dans la solution.
En prenant le logarithme (en base 10) : log KA=……………………………………... donc
pH= ………………………..............
Exemple de couples voir livre (annexe à la fin). Noter que A- ou B correspond à l’espèce …………….........
(capable de………... un proton) , HA ou BH+ correspond à l’espèce ………………….......(capable de ……………..un proton)](transfoacidobasiques_fichiers/image003.gif)
Exemple : Couple acide éthanoïque / ion éthanoate. Equation de la réaction avec l'eau:
CH3—COOH + H2O = CH3—COO- + H3O+
Expression de la constante d'acidité : KA=……………………………………………
Valeur à 25°C: KA = 1,58.10-5 et pKA = ……………=….......
2°) Couples de l’eau : L’eau étant amphotère, elle fait partie de 2 couples acido-basiques distincts qui sont
H2O/ OH- et H3O+/ H2O. Les 2 réactions correspondantes sont :
réaction 1 H2O +H2O = OH- + H3O+ KA = Ke = …………………..= 1,0 10-14 à 25 °C couple ………..
(l’eau est utilisé comme ………………..)
réaction 2 H3O+ +H2O = H2O + H3O+ KA = Ke = …………………=…………à 25 °C couple ……….
(l’eau est utilisé comme ………………..)
III°) Comportement des acides et des bases en solutions aqueuses :
1°) Pour un même état initial, donc pour une même concentration apportée en réactif, comment vont se comporter
différents acides?
Activité :
Soit trois solutions de concentration c = 1,0.10-2 mol/L
|
Solution |
S1 acide éthanoïque (CH3COOH) |
S2 : acide méthanoïque (HCOOH) |
S3 acide chlorhydrique (HCl) |
|
pH |
3,4 |
2,9 |
2,00 |
Ø Comparez les taux d’avancement final de la réaction de ces différents acides avec l’eau (Ecrire l’équation bilan au
préalable puis calculer le taux d’avancement final).
Ø Calculer la valeur de KA puis de pKA pour ces 3 acides mis dans l’eau.
Ø Que peut – on déduire de ces résultats ? (justifications avec les calculs au dos de la feuille)
|
Acide |
pH |
|
KA |
pKA |
|
Acétique |
3,4 |
……… |
…………. |
…………. |
|
méthanoïque |
2,9 |
……… |
…………. |
…………. |
|
chlorhydrique |
2,0 |
1 |
2.106 |
-6,3 |
|
A concentration identique :
- un acide est
d’autant plus fort
que la constante d’acidité KA de son couple est ………………
et donc son pKA
est …………………..
- un acide AH1 est plus fort que l’acide AH2 si le
taux d’avancement final de sa réaction avec l’eau est plus ………….
|
Conclusion :
Exercice d’application (réponses derrière la feuille) :
|
|
S1 acide benzoïque (C6H5COOH) |
S2 : acide bromhydrique (HBr) |
S3 chlorure d’ammonium (NH4++Cl-) |
|
pH |
....... |
............... |
............ |
Concentration des 3 solutions : = 5.0.10-3 mol/L
Données : C6H5COOH/ C6H5COO- pKA1 = 4,2
HBr/Br- pKA2 = - 4,1
NH4 + / NH3 pKA 3 = 9,2
Ø Ecrire les équations bilan traduisant la réaction de ces acides avec l’eau :
Ø Classer les acides par ordre de dissociation croissante
Ø Attribuer à chaque solution son pH parmi les valeurs ci dessous : 5,8 ; 2,3 ; 3,3.
2°) Pour un même état initial, donc pour une même concentration apportée en réactif, comment vont se comporter
différentes bases ?
Activité (réponses derrière la feuille) :
Soit trois solutions de concentration c = 1,0.10-2 mol/L
|
|
S1 ammoniac (NH3) |
S2 : méthylamine |
S3 : éthanolate de sodium |
|
pH |
10.6 |
11.4 |
12,0 |
Ø Comparez les taux d’avancement final de la réaction de ces différentes bases avec l’eau (Ecrire au préalable
l’équation bilan de l’ammoniac avec l’eau : les 2 autres équations sont
similaires puis faire le calcul de
![]() ).
).
Ø Calculer la valeur de KA puis de pKA pour ces 3 bases dans l’eau.
Ø Que peut – on déduire de ces résultats ?
|
Acide |
pH |
|
KA |
pKA |
|
Ammoniac |
10,6 |
……….. |
……….. |
……….. |
|
méthylamine |
11,4 |
……….. |
……….. |
……….. |
|
ion éthanolate |
12,0 |
1 |
1,3.10-16 |
15,9 |
Conclusion :
|
A concentration identique :
- une base est d’autant plus forte que la constante d’acidité KA
de son couple est ……………… et
donc son pKA est
…………………..
- une base A1- est plus fort que la baseA2-
si le taux d’avancement final de sa réaction avec l’eau est plus ………….
|
Remarque : À un acide de plus en plus fort correspond une base conjuguée de plus en plus ……………………….., et à une
base de plus en plus forte correspond un acide conjuguée de plus en plus ……………………. (voir livre p 134).
IV°) Diagramme de prédominance et distribution des espèces acido-basiques :
1°) Définition :
Une espèce A est prédominante par rapport à une espèce B si: [A] > [B]
2 °) Relation donnant le pH d'une solution aqueuse en fonction de son pKA :
![]()
On a KA=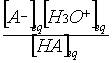 donc [H3O+]éq
= …………………………soit - log[H3O+]éq = ………………………….
donc [H3O+]éq
= …………………………soit - log[H3O+]éq = ………………………….
donc
3°) Domaine de prédominance :
![Zone de Texte: D'après ce qui précède :- si pH<pKA alors ………………………donc [AH]éq >[A-]éq la forme acide ………………… en
solution. - si pH=pKA alors ………………………donc [AH]éq =[A-]éq la forme acide et basique ont des
concentrations identiques à l’équilibre.
- si pH>pKA alors ………………………donc [AH]éq <A-]éq la forme basique ………………… en
solution. On peut représenter graphiquement les diagrammes de distribution et de prédominance pour un couple HA/A- comme suit :](transfoacidobasiques_fichiers/image011.gif)
Diagramme de prédominance :
On peut également représenter le pourcentage de l'espèce acide et de l'espèce conjuguée basique en fonction du pH.
On trouve ci-dessous ce diagramme de distribution :
4°) Application aux indicateurs colorés (voir TP n°10 de chimie) :
Un indicateur coloré est un couple acide/base conjuguée (on le notera: InH / In- ), dont la forme acide InH et la
forme basique In- ont des couleurs différentes en solution.
* On admet que la solution dans laquelle se trouve l'indicateur a la couleur de la forme acide InH si [InH]>10[In-].
Soit KA la constante d'acidité associée à ce couple. La solution aura la couleur de la forme acide si [InH] > 10[In-] …………………………………..…….. =>……………………………………………. donc pH < pKA - 1
* De la même façon la solution dans laquelle se trouve l'indicateur a la couleur de la forme basique si:[In-] > 10[InH]
……………………………………..……… => ……………………………………donc pH > pKA + 1
* La solution prendra une couleur appelée teinte sensible (mélange des couleurs dues à la forme acide et à la forme basique) si
[InH] et [In-] sont du même ordre de grandeur, donc si: pKA-1<pH<pKA+1.
On résume en général, ces situations sur le diagramme de prédominance donné ci-dessous :
|
pH |
Domaine de prédominance de la forme
acide InH [InH] =[In-] Domaine de prédominance de
la forme basique In-
[InH] > 10[In-] pKA-1 pH= pKA pkA+1 [In-] > 10[InH]
V°) Constante d'équilibre associée à une réaction acido-basique :
1°) Equation de la réaction :
Une réaction acido-basique est un transfert de proton entre l'acide A1H d'un couple A1H/A1- et la base A2-
d'un couple A2H/A2-. L'équation de la réaction peut être considérée comme la somme des deux demi-équations relatives à
chaque couple : ………………………………=………………………………
……………………………….=………………………………
……………………………….=………………………………..
2°) Constante d'équilibre associée :
On ne notera plus éq en bas et à droite de chaque concentration, mais on oubliera pas qu'il s'agit des concentrations
à l'équilibre. La constante d'équilibre associée à l'équation de la réaction est
: K=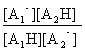
En multipliant le numérateur et le dénominateur par la concentration en ions oxonium on fait apparaître les constantes d'acidité
associées à chaque couple mis en jeu : K=![]() .=
.=![]()
donc K=![]() =……………………
=……………………
en posant: pKA2-pKA1=DpKA, on pourra écrire K=10DpKA
3°) Sens de l'évolution de la transformation :
La transformation est favorisée dans le sens où l'équation est écrite (de la gauche vers la droite) si K>1.
Elle est favorisée dans le sens inverse (de la droite vers la gauche) si K<1.
On a vu dans le chapitre précédent qu’une réaction peut être considérée comme quasi totale si son taux d’avancement t
est supérieur à 0,99 (99%) cela correspond à une constante d’équilibre K>104.