![]()
Transformations spontanées : les piles
![]()
TP n°16 (Chimie)
Objectifs : -montrer que l’on peut récupérer de l’énergie électrique à partir d’une transformation chimique ?
- simuler l’usure d’une pile lors de sa décharge.
I°) Transformation chimique spontanée avec transfert direct d’électrons :
Couples oxydant/réducteur mis en jeu : Cu2+(aq)/Cu(s) et Zn2+(aq)/Zn(s)
-Mettre dans un bécher environ 5 mL de solution de sulfate de cuivre (II) de concentration c =0,5
mol/L et 5 mL de la solution de sulfate de zinc (II) de même concentration.
- Prélever quelques mL (environ 2 mL) de ce mélange dans un tube à essai (tube témoin).
- Placer environ 1 g de copeaux de zinc et environ 1 g de tournure de cuivre dans le bécher.
- Agiter.
- Récupérer quelques mL du mélange ainsi réalisé (sans les copeaux ni la tournure) dans un tube à essai.
Comparer les 2 couleurs.
Questions :
1°) D’après les observations, écrire l’équation de la réaction associée à la transformation chimique
du système (Cu2+ à gauche).
2°) La constante d’équilibre, K, associée à cette
réaction est égale à 2,0![]() 1037. En appliquant le critère
1037. En appliquant le critère
d’évolution, montrer que le sens d’évolution prévu est compatible avec les observations expérimentales.
II°) Réalisation d'une pile :
Le transfert mis en évidence au cours de l’expérience n°1 est-il encore possible en séparant les deux couples
oxydant / réducteur.
1°) Étude du fonctionnement de cette pile en circuit ouvert :
· Remplir un tube à hémolyse avec la solution de sulfate de cuivre (II) de concentration c = 0,5 mol/L
· Faire de même avec un tube contenant du sulfate de zinc (II) de même concentration.
· Placer un papier filtre imbibé de K+ + NO3- saturé entre les 2 tubes.
· Plonger une lame de zinc muni d’une pince crocodile dans le compartiment contenant les ions
Zn2+ (aq).
· Plonger une lame de cuivre muni d’une pince crocodile dans le compartiment contenant les ions
Cu2+(aq).
· Montrer à l’aide d’un voltmètre qu’il existe une tension aux bornes de la pile (différence de potentiel),
appelée force électromotrice ( f.e.m notée E).
Questions :
1°) Identifier le pôle + et le pôle – de la pile ainsi réalisée.
2°) Quel métal a le potentiel le plus élevé ?
2°) Étude du fonctionnement de cette pile en circuit fermé :
· Proposer un montage permettant de faire circuler les électrons échangés entre les 2 couples rédox
à travers une résistance. Placer en même temps un ampèremètre permettant de mesurer l’intensité I
du courant.
Questions :
1°) Faire un schéma du circuit en notant le sens conventionnel du courant et en couleur le sens réel de
déplacement des électrons.
2°) Montrer que le sens de circulation des électrons satisfait au critère d’évolution spontanée.
3°) Ecrire les équations des réactions aux électrodes.
4°) Comment varient [ Zn2+(aq)], [Cu2+(aq).], nZn, nCu ? Comment est assurée l'électroneutralité
des solutions ?Indiquer le mouvement des porteurs de charge dans l’ensemble du dispositif, en
particulier dans le papier filtre imbibé de K+ + NO3- saturé.
5°) La pile en fonctionnement est-elle un système à l'équilibre ou hors équilibre ?
III°) Simulation du comportement électrique d’une pile (expérience collective) :
La transformation étant très lente, diverses piles sont construites pour simuler différents états du
système chimique au cours de son évolution. Un multimètre permet de mesurer la f.e.m aux bornes de la pile.
Vous allez simuler l’usure de la pile au cours de sa décharge.
La pile réalisée par les différents binômes
se note : -
Cu(s)/ Cu2+(aq)+SO![]() // Ag+(aq)+NO3(aq)
+
// Ag+(aq)+NO3(aq)
+
1°) Chaque binôme réalise une des piles suivantes, correspondant à différentes valeurs de l’avancement
de la réaction mise en jeu dans la pile. La pile n°1 est réalisée au bureau par le professeur.
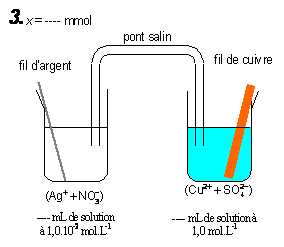
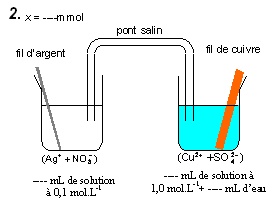

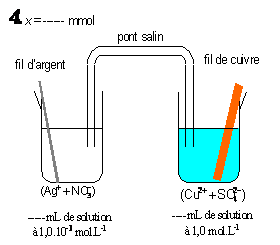
2°) Complétez le tableau proposé ci-dessous qui rassemble les différents états du système chimique
au cours de la décharge de la pile :
3°) Conclure sur ce que veut dire « une pile s’use » ?
|
Pile n° |
Equation de la réaction |
2 Ag+(aq) + Cu(s) = 2 Ag(s) + Cu2+(aq) |
E (V) |
|||
|
1 |
Quantité de matière dans l’état initial (mmol) |
|
|
|
|
|
|
|
Quantité de matière au cours de la transformation : avancement x (mmol) |
|
|
|
|
|
|
2 |
Quantité de matière à l’avancement x = 4,5 mmol |
|
|
|
|
|
|
3 |
Quantité de matière à l’avancement x = 4,95 mmol |
|
|
|
|
|
|
4 |
Quantité de matière à l’avancement x = 4,995 mmol |
|
|
|
|
|