À la poursuite de l'élément cuivre
TP n°8![]()
Objectifs : - Réaliser quelques expériences mettant en jeu l’élément chimique cuivre.
- Mettre en évidence une caractéristique importante de la réaction chimique.
- Mettre en évidence le fait que le mot cuivre n’est pas assez précis pour interpréter les réactions qui vont
suivre.
Remarques : comme d’habitude ne pas oublier de faire des schémas pour présenter une expérience. Dans tout ce qui suit,
il est conseillé d’utiliser les informations du tableau du III°.
Comment peut-on reconnaître simplement le cuivre d’autres métaux comme le fer, le plomb…
1) Réaction 1 : Prendre un petit copeau de cuivre et l’introduire dans un tube à essai. Ajouter avec une pipette simple
environ 1 mL d’acide nitrique (Regarder le pictogramme pour cette substance).
Le port de lunettes, des gants, et de la blouse est-il obligatoire ?
Observer. A quoi peut-on dire que la réaction est terminée ?
Quelle est la formule chimique de l’espèce formée (aller sur la paillasse du professeur pour confirmer).
2) Réaction n°2 : Quand la réaction chimique mettant en jeu le cuivre et l’acide nitrique est terminée; avec une pipette
simple, prélever un peu de la solution bleue et en déposer une goutte au milieu de la lame de fer. Au
bout de 1 à 2 minutes, rincer la lame de fer à l’eau du robinet.
Identifier la tache observée.
Quelle est la formule chimique de l’espèce formée.
Interprétations : Les « Gremlins » sont des êtres imaginaires : admettons que l’on en a enfermé 5 dans une boîte; voir
le schéma ci-dessous.
On observe la boîte le matin et le soir.
|
A partir des schémas des deux boîtes
rectangulaires ci-contre répondre aux
questions a°) et b°) :
a°) Qu’est ce qui ne s’est pas
conservé dans cette boîte ?
b°) Qu’est ce qui s’est conservé
pendant la transformation ? |
La boîte le matin La même boîte le soir
|
Dans les deux questions suivantes, on ne se préoccupe pas de l’acide nitrique.
A propos de l’expérience entre le cuivre et l’acide nitrique, nous allons tenter de faire le parallèle avec les
« Gremlins »:
c°) Indiquer ce qui ne s’est pas conservé dans le tube à essai ?
d°) Indiquer ce qui s’est conservé ?
Pour continuer vous ajouterez environ 1 mL d’eau dans la solution bleue précédente (solution S).
3) Réaction n°3 : Répartir la solution S dans 2 tubes à essai. Ajouter 2 à 3 mL de soude dans un des deux tubes.
Observer en comparant avec le tube témoin.
Quel est la formule de l’espèce chimique formée.
4) Réaction n°4 : Prendre le tube à essai précédent (celui qui contient le précipité). Ajouter y de l’acide chlorhydrique
goutte à goutte. Arrêter au moment où le précipité vient de disparaître.
Quelle espèce chimique a-t-on de nouveau mis en évidence.
II°) Réaction avec l’oxyde de cuivre (manipulation professeur) :
Le professeur chauffe fortement un mélange d’oxyde de cuivre (CuO) et de carbone en poudre (C ).
Un nouveau solide est apparu. De qui s’agit-il ?
L’élément chimique cuivre est-il présent au départ (Justifier)
III°) Travail de réflexion :
1°) A partir des expériences réalisées , compléter le tableau suivant :
|
formule chimique |
Aspect Couleur |
Etat Physique |
Nature chimique : atome, ion ou précipité ? |
obtenu par quelle réaction ? |
|
Cu2+
|
bleu pâle |
en solution |
...................... |
...............................................................
..................................................................... |
|
Cu
|
rouge-orangé |
solide |
........................ |
......................................................................... |
|
Cu(OH)2
|
bleu |
solide |
......................... |
.......................................................................... |
2°) Deux transformations chimiques vues pendant cette séance de TP peuvent être symbolisées ainsi :
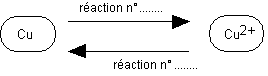
Préciser lesquelles en rappelant leur n° au dessus de la flèche correspondante.
3°) A l’image de ce qui vient d’être symbolisé, il est possible de faire le cycle ci-dessous avec d’autres réactions
vues pendant la séance de TP :

Compléter ce schéma en précisant la nature chimique du cuivre (écrire la formule), ainsi que le n° de la
![]() réaction qui a permis sa transformation ?
réaction qui a permis sa transformation ?
4°) Etablir une conclusion d’ensemble en rappelant le principe de Lavoisier pour une réaction chimique.