 des
solutions.
des
solutions.
Les piles : systèmes mettant en jeu des transformations spontanées
(chapitre 11 de Chimie)
I°) Constitution d'une pile électrochimique.
a°) Définition.
Une pile électrochimique est un............................ qui transforme une partie de l'énergie ........................ venant d'une
réaction d'oxydoréduction spontanée en ..................................
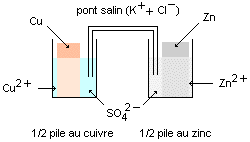
b°) Description générale d'une pile et exemple.
1°) Les différentes parties de la pile.
Les piles présentent toutes :
- Deux ................................ constituées de matériaux conducteurs (en général des métaux ou du carbone).
- Une ou plusieurs solutions électrolytiques (les ions nécessaires au fonctionnement peuvent être présents dans un gel.
- Un pont salin ou une paroi poreuse.
2°) Rôle du pont salin (ou de la paroi poreuse).
Le pont salin est constitué d'un tube en U creux rempli d'une solution gélifiée conductrice concentrée (ou d'une simple
feuille de papier imbibé d'ions). Les ions présents dans le pont salin (en général K+ et Cl- ou NO3-) n'interviennent pas
dans la réaction d'oxydoréduction qui est la source de l'énergie électrique. On dit qu'ils sont .............................inertes.
Leur rôle est d'une part de permettre le passage du courant dans la pile (donc d'assurer ..................................................
....................................................)et
d'autre part d'assurer la neutralité électrique  des
solutions.
des
solutions.
II°) Fonctionnement de la pile.
1°) Polarité de la pile.
On appelle polarité, la nature ................................... de chaque électrode. Elle peut être déterminée de plusieurs façons.
Méthode théorique.
Lorsque la pile fonctionne (il faut pour cela qu'elle soit reliée à un circuit extérieur), elle est le siège d'une réaction
d'oxydoréduction mettant en jeu les couples Cu2+ / Cu et Zn2+ / Zn. On peut écrire l'équation de la réaction de la façon
suivante: Zn + ................. = ...............+ ...................
La constante d'équilibre K associée à cette équation (et pas l'inverse) est K=2.1037. Mais le quotient de réaction initial
est Qri=...............................=...............................= ....................
La pile fonctionne hors équilibre (Qri ![]() K).
On a Qri ......... K le système chimique évolue dans le sens
direct de l'équation
K).
On a Qri ......... K le système chimique évolue dans le sens
direct de l'équation
ce qui signifie que le zinc
.............................................................................................
Le zinc apparaît donc comme un donneur
.................................., il constitue la borne négative de la pile.
Le cuivre est
alors la borne positive.
Méthodes expérimentales.
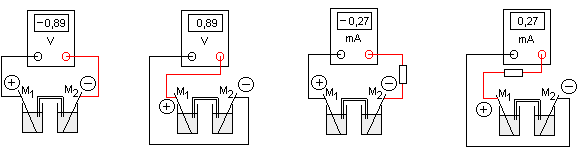 Elles consistent à brancher un voltmètre aux bornes de la pile ou de brancher un
ampèremètre en série dans le circuit dans
Elles consistent à brancher un voltmètre aux bornes de la pile ou de brancher un
ampèremètre en série dans le circuit dans
lequel la pile débite le courant. Ces appareils de mesure sont tous les deux munis de deux bornes qui permettent leur
branchement. L'une de ces bornes est en général colorée (en rouge) , c'est la borne de mesure (V ou mA). L'autre borne est
en général noire, c'est la borne
COM.
Le signe de la valeur lue sur l'appareil de mesure correspond à la polarité de l'électrode à laquelle la borne de mesure est
reliée (voir schémas ci-dessous et TP).
2°) Les réactions dans chaque demi-pile et le bilan électrochimique de la pile :
a°) Exemple de la pile au cuivre et au zinc.
La borne négative est constituée par le ....................... qui est donc un donneur d'électrons.
......................................
A la borne négative il se produit une oxydation (perte d'électrons) de ........ ..en ..............
La borne positive est constituée par .................... Dans cette demi-pile ................ reçoit les électrons cédés par le zinc.
.....................................
|
A la borne positive il se produit une réduction de ............. en ............... Le bilan électrochimique de la pile est : .............................................................. |
b°) Généralisation :
|
A la borne négative (anode) il se produit l'oxydation du réducteur 1 |
(Red1 = Ox1 + n1e-) x..... |
|
|
|
|
A la borne positive il se produit la réduction de l'oxydant 2 |
(Ox2 + n2e- = Red2)x........ |
Le bilan électrochimique est alors: ........................................................
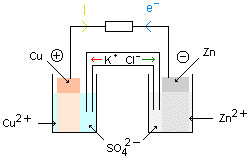
3°) Mouvement des porteurs de charges.
Lorsque la pile débite, les porteurs de charges sont de deux sortes:
- Dans le circuit extérieur à la pile, ce sont de .................. qui circulent dans les fils et dans les conducteurs
de la borne négative vers la borne positive (le sens conventionnel du courant est alors de la borne positive
vers la borne négative).
- Dans le pont salin et dans les solutions, ce sont des ...... qui se déplacent. Le mouvement des ....... dans le pont
salin est tel que les solutions restent électriquement neutre. Dans la demi-pile qui s'enrichit en cations (électrode ....)
le pont salin apporte de ............. et dans la demi-pile qui s'appauvrit en cations (électrode.........) le pont salin
apporte des cations.
4°) Représentation formelle d'une pile.
Deux cas peuvent se présenter.
a°) Cas où les couples mis en jeu sont tous les deux de la forme Mn+ / M (où M est un métal qui joue le rôle d'électrode).
La représentation formelle de la pile est obtenue en plaçant la borne négative à gauche et en indiquant les espèces
chimiques rencontrées dans la pile. Le pont salin est représenté par une double barre.
![]()
b°) Cas où les couples mis en jeu ne font pas apparaître de métal.
Les électrodes sont alors constituées d'un conducteur inerte (en général le platine Pt ou le carbone).
![]()
III°) Grandeurs caractéristiques :
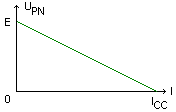 1°) Force électromotrice E et
résistance interne r.
1°) Force électromotrice E et
résistance interne r.
La caractéristique intensité tension d'une pile a été vue en 1°S; Son équation est: UPN=E-rI.
* E est appelée ................................(f.e.m) de la pile. Elle se mesure en volt. C'est la tension aux bornes
de la pile lorsqu'elle........................................ Pour la mesurer il suffit de brancher un voltmètre aux bornes
de la pile lorsqu'elle n'est pas reliée à un circuit. E est alors égale à la valeur absolue de la valeur affichée
par le voltmètre.
* r est la résistance interne de la pile. Elle se mesure en ohm (W). Elle est numériquement égale à l'opposé
du coefficient directeur de la caractéristique intensité-tension.
ICC est le courant de court-circuit (quand il n'ya plus de ........................... aux bornes de la pile)
2°) Quantité d'électricité maximale débitée par la pile: Capacité en charge de la pile.
a°) Tableau d'évolution du système chimique :
Considérons la réaction d'équation: 2Ag+ + Cu = 2Ag + Cu2+ vue dans le TP n°16 à laquelle est associée
la constante d'équilibre K. On dresse le tableau d'évolution de la transformation faisant apparaître l'état initial et l'état
final atteint au bout d'une durée Dtmax pour laquelle la pile est usée (cesse de fonctionner).
|
Équation de la réaction |
2Ag+ + Cu = 2Ag + Cu2+ |
|||
|
Etat initial (mol) |
n(Ag+)i |
n(Cu )i |
n(Ag )i |
n(Cu2+)i |
|
Etat final (mol) |
n(Ag+)f=n(Ag+ )i-2x f |
n(Cu )f= n(Cu )i-xf |
n(Ag )f=n(Ag )i+2x f |
n(Cu2+)f=n(Cu2+)i+xf |
b°) Quantité maximale d'électricité débitée :
Si l'on suppose que l'intensité du courant débité est constante: Qmax = I Dtmax.
Soit n la quantité de matière (en moles) d'électrons fournie par Cu pendant Dtmax, alors Qmax = n NA e.
Dans cette expression NA est le nombre d'Avogadro (NA=6,02.1023mol-1) et e est la quantité d'électricité (charge )
transportée par un électron (valeur absolue de sa charge).
Le produit NA e = F est appelé faraday et vaut F=96500C.
A l'aide des demi équations rédox, il est possible de relier Qmax aux quantité de matière formées ou consommées.
On a en effet: Cu = Cu2+
+ 2e- et Ag+ +e- = Ag.
La
formation d'une mole de Cu2+ s'accompagne de la libération de 2
moles d'électrons. D'après le tableau
d'évolution il est apparu xf moles de Cu2+. Il est donc passé une quantité de matière d'électrons de .......... Alors:
|
n = 2xf |
=> |
Qmax = 2xfF = IDtmax |
En s'intéressant à la disparition de Ag+ on a de la même façon (même type de raisonnement)
|
n = ......... |
=> |
Qmax = ........xfF = IDtmax |
Ces relations permettent de déterminer xf. Connaissant les quantités de matières initiales, on peut alors déterminer si la pile
cesse de fonctionner parce que le système chimique est à l'équilibre (Qri=K) ou parce que l'un des réactifs est limitant (en
défaut donc totalement consommé).
IV°) Un exemple de pile usuelle: pile Leclanché :
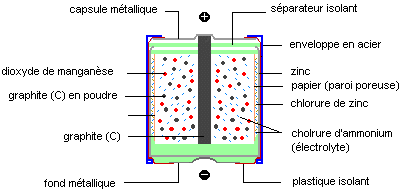 1°) Vue en coupe et description de la
pile.
1°) Vue en coupe et description de la
pile.
- Le pôle négatif est constitué par le zinc métallique Zn qui est en contact avec du chlorure de zinc ZnCl2 en solution
aqueuse gélifiée Zn2+ + 2Cl-. Cet ensemble met en jeu le couple Zn2+ / Zn.
- L'électrolyte est une solution acide et gélifiée de chlorure d'ammonium NH4+ + Cl-.
- Le pôle positif est un bâton de graphite (carbone). C'est une électrode inerte (ne participe pas à la réaction).
Cette électrode est au contact du dioxyde de manganèse qui est l'oxydant du couple MnO2 / MnO(OH).
- Des grains de graphite assurent une meilleure conduction.
2°) Les demi-équations rédox aux électrodes et le bilan électrochimique.
|
|
Zn |
= Zn2+ + 2e- |
|
|
|
|
|
|
(MnO2 + H+ + e- |
=MnO(OH)) x2 |
|
Equation bilan |
Zn + 2MnO2 + 2H+ |
=Zn2+ + 2MnO(OH) |
Cette pile a une force électromotrice voisine de 1,5V. Le réactif en défaut est le dioxyde de manganèse.
3°) Remarques.
- La pile précédente est dite "sèche" car elle ne contient pas de solution aqueuse mais un gel qui évite à la pile de couler.
- L'électrolyte du pont salin (paroi poreuse) qui assure le passage du courant est un sel (produit de l'action d'un acide sur une
base). Pour cette raison la pile est dite "pile saline".
- Dans un autre type de piles dites "piles alcalines" l'électrolyte est basique (alcalin), par exemple une solution gélifiée
d'hydroxyde de potassium (K+ + HO-).