
Titrage pH-mètriques (chapitre 9 de chimie)
Introduction : La notion de dosage (ou dosage) a déjà à été rencontrée en classe de 1°S lors des dosages conductimètriques.
Nous allons ici reprendre cette notion en l’appliquant au cas des dosages acido-basiques.
I°) Notion de titrage acido-basique :
1°) Définition :

La réaction de dosage doit satisfaire à plusieurs critères: - elle doit être totale (ou doit pouvoir être considérée comme
totale). On doit donc avoir: ………………….
- elle doit être unique et rapide
2°) Dispositif expérimental :

3°) Allure générale de la courbe de titrage :
L'allure générale de la courbe de titrage dépend de la nature de la solution à titrer (placée dans le bécher). S'il s'agit d'une
solution acide, le pH initial est inférieur à 7 (courbe ci-dessous). S'il s'agit d'une solution basique, le pH initial est supérieur à 7 .
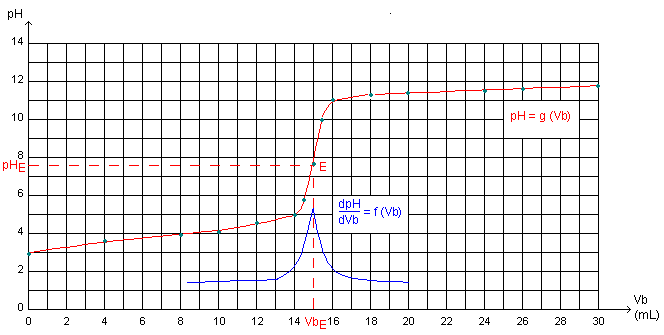
4°) Equivalence :
La courbe précédente fait apparaître un point singulier noté E et appelé point équivalent. En ce point, le coefficient
directeur de la tangente passe par un maximum.
Au point équivalent E :
![]() =f(Vb) passe par un maximum (voir courbe
ci-dessus).
=f(Vb) passe par un maximum (voir courbe
ci-dessus).

II°) Repérage du point équivalent :
Le point équivalent peut être repéré par trois méthodes. La méthode des tangentes parallèles, la méthode de la dérivée
et l'utilisation d'un indicateur coloré (on parle alors d'un titrage colorimétrique).
La méthode des tangentes parallèles est une méthode graphique :
* Tracer, de part et d'autre du saut de pH, deux tangentes (T1 et T2) à la courbe, parallèles entre elles.
* Tracer une droite perpendiculaire (D) à ces deux tangentes : elle coupe en 2 points ces 2 tangentes.
* Tracer la médiatrice au segment formé par les 2 points précédents: elle coupe la courbe pH=f(Vb) en
un point qui est le point équivalent.
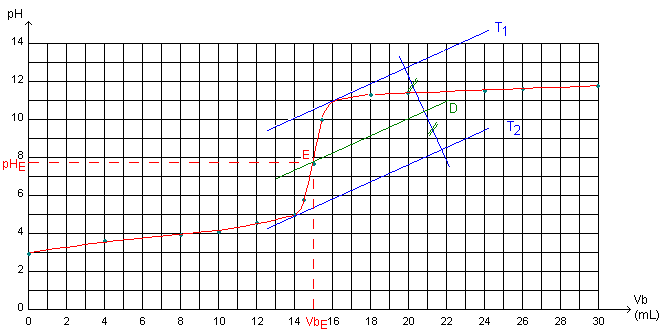
La méthode de la dérivée est une méthode numérique qui nécessite l'utilisation d'un ordinateur (tableur (EXCEL) pour
calculer la dérivée). Ces deux méthodes sont développées dans le TP n°10.
III°) pH à l'équivalence :
Il faut envisager trois situations.
* Titrage d'une solution d'acide faible AH par une solution de base forte représentée par l'ion HO-aq.
L'équation de la réaction est:
AHaq + HO-aq ® A-aq + H2O
La réaction étant totale, à l'équivalence les espèces AH aq et HO-aq ont totalement disparu. La solution ne contient
alors que la base A-aq. Le pH est donc......................... à ……………..
* Titrage d'une solution de base faible A-aq par une solution d'acide fort représentée par l'ion H3O+.
L'équation de la réaction est :
A- aq + H3O+ ® AHaq + H2O
La réaction étant totale, à l'équivalence les espèces A- aq et H3O+ ont totalement disparu. La solution ne
contient alors que l'acide AHaq. Le pH est donc ……………………….à ..................
* Titrage d'une solution d'acide fort (ou de base forte) par une solution de base forte (ou d'acide fort).
L'équation de la réaction est:
HO-aq + H3O+ ® 2H2O
Le pH est celui de l'eau, c'est-à-dire .............à 25°C.
IV°) Choix d'un indicateur coloré :
On choisit un indicateur coloré de telle façon que la détermination du point équivalent soit la plus précise possible.
En général on choisit un indicateur coloré tel que le point équivalent se situe dans sa zone de virage (voir TP n°10).
V°) Détermination de la concentration de la solution à titrer.
Soit à déterminer la concentration d'un acide [AHaq] à l'aide d'une solution titrante de soude (Na+aq + OH-aq).
A l'équivalence on a: n (AH)initiale = n(HO-)versé à l'équivalence=> CAcide inix VAcide ini = CBasex Vbase à l'équivalence
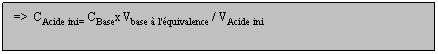
Le même raisonnement est valable dans le cas où l'on titre une solution de base (A-aq)par une solution
titrante d'acide (H3O+).
On aura alors: n (A-aq)initiale = n(H3O+)versé à l'équivalence=> ............................................
